Definicja prawa zachowania masy
Prawo zachowania masy głosi, że masa całkowita układu zamkniętego przed i po reakcji chemicznej jest stała. Oznacza to, że żadna materia nie zostaje ani wytworzona, ani zniszczona w trakcie reakcji chemicznej. Najprościej mówiąc: suma masy substratów musi być równa sumie masy produktów.
Lavoisier – który odkrył to prawo – przeprowadził liczne eksperymenty potwierdzające, że masa reagentów (substancji reagujących) przed reakcją chemiczną jest równa masie produktów reakcji. W tym kontekście reakcje chemiczne są traktowane jako procesy, w których atomy reagujących substancji łączą się lub przekształcają, ale ich liczba i rodzaj nie zmieniają się w trakcie przemiany.
Przeczytaj również:

Prawo stałości związku chemicznego – definicja, zadania
Krótka historia odkrycia
Antoine Lavoisier – francuski chemik i fizyk – uznawany jest za ojca współczesnej chemii. W XVIII wieku przeprowadził szereg precyzyjnych eksperymentów, które wykazały, że masa substancji biorących udział w reakcji chemicznej nie zmienia się. W swoich badaniach dowiódł, że tlen ma główne znaczenie w procesach spalania, a niektóre substancje reagujące z tlenem nie znikają, lecz tworzą się nowe związki chemiczne.
Dzięki tym odkryciom Lavoisier udowodnił, że masa w procesach chemicznych nie znika, lecz pozostaje niezmienna – niezależnie od tego, jakie reakcje mają miejsce. Jego badania miały ogromny wpływ na rozwój chemii jako nauki i aktualnie stanowią podstawę współczesnej wiedzy o reakcjach chemicznych.
Przeczytaj również:

Wzór na stężenie procentowe – jak obliczyć stężenie procentowe roztworu?
Zastosowanie prawa zachowania masy w chemii
Prawo zachowania masy ma podstawowe znaczenie w chemii, ponieważ pozwala na przewidywanie wyników reakcji chemicznych. Dzięki temu chemicy mogą obliczyć, jakie ilości reagentów będą potrzebne, aby uzyskać określoną ilość produktów. Zasada ta stanowi podstawę do tworzenia równań reakcji chemicznych i bilansowania reakcji chemicznych w laboratoriach (współczynniki stechiometryczne).
Bilansowanie reakcji chemicznych to proces, w którym uwzględnia się liczbę atomów każdego pierwiastka, aby zachować zgodność z prawem zachowania masy. W przypadku reakcji, w których zachodzi przekształcenie jednej substancji w inną, chemicy muszą zadbać o to, by liczba atomów przed i po reakcji była taka sama.
Przykładowe – dobrze zbilansowane – równanie reakcji chemicznej to:
2KOH + H2SO4 → K2SO4 + 2H2O
Możemy zauważyć, że liczba poszczególnych atomów jest taka sama po lewej, jak i po prawej stronie.
Prawo zachowania masy w kontekście reakcji fizycznych
Należy zaznaczyć, że prawo zachowania masy jest najczęściej omawiane w kontekście reakcji chemicznych, jednak ma ono także zastosowanie do procesów fizycznych, takich jak przemiany fazowe czy zmiany stanu skupienia. W tych procesach nie zachodzi żadna zmiana chemiczna substancji, ale ich masa również pozostaje stała. Przykładami takich procesów są: topnienie lodu, parowanie wody czy kondensacja pary wodnej. W każdym z tych przypadków łączna masa substratów przed zmianą stanu skupienia jest taka sama jak masa produktów po tej zmianie, co jest zgodne z prawem zachowania masy.
Warto również dodać, że choć prawo zachowania masy jest prawdziwe w większości przypadków, to w szczególnych sytuacjach – takich jak reakcje jądrowe – może wystąpić niewielka zmiana masy, która jest związana z uwolnieniem energii. W tych reakcjach – jak w przypadku rozpadu radioaktywnego – różnice w masie są jednak bardzo małe i często nie mają wpływu na codzienne reakcje chemiczne.
Przeczytaj również:

1. zasada dynamiki Newtona – wytłumaczenie i przykłady
Przykłady reakcji, w których występuje prawo zachowania masy
Spalanie węgla – w reakcji spalania węgla w obecności tlenu powstaje tlenek węgla (IV). Masa węgla i tlenu przed reakcją jest równa masie dwutlenku węgla powstałego w wyniku reakcji.
Reakcja tworzenia wody – woda (H₂O) powstaje w reakcji wodoru (H₂) z tlenem (O₂). Przed reakcją masa wodoru i tlenu sumuje się do tej samej masy, co woda po reakcji.
Reakcje kwasu i zasady – w reakcjach zobojętniania, podczas których kwas i zasada tworzą sól i wodę, całkowita masa reagentów jest równa masie produktów końcowych.
Zadania związane z prawem zachowania masy
Zadanie 1. W reakcji 4 g kwasu siarkowego (H₂SO₄) przereagował tlenek wapnia (CaO). W wyniku reakcji powstał siarczan wapnia (CaSO₄) i woda (H₂O). Oblicz masę każdego z produktów reakcji.
Reakcja chemiczna:

Rozwiązanie:
To zadanie można rozwiązać za pomocą proporcji i bilansowania reakcji:
4 g kwasu siarkowego – x g siarczanu wapnia
98 g kwasu siarkowego (masa z układu okresowego) – 136 g siarczanu wapnia
x = 5,55 g siarczanu wapnia
4 g kwasu siarkowego – x g wody
98 g kwasu siarkowego – 36 g wody
x = 1,47 g wody
Odpowiedź: Masa siarczanu wapnia to 5,55 g, a masa wody to 1,47 g.
Zadanie 2. Oblicz, ile gramów wody powstaje w reakcji 8 g wodoru z 64 g tlenu.
Reakcja chemiczna:
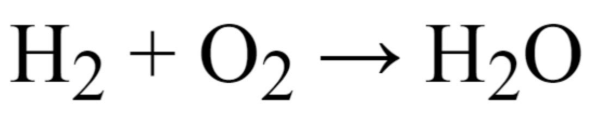
Rozwiązanie:
To zadanie należy do łatwych zadań szacunkowych.
8 g + 64 g = x
x = 72 g
Odpowiedź: W reakcji 8 g wodoru z 64 g tlenu powstają 72 g wody.
Przeczytaj również:

Wzór na ciśnienie hydrostatyczne – jak obliczyć?
Podsumowanie – wiedza w pigułce
Prawo zachowania masy jest jednym z podstawowych praw fizycznych, które stanowi fundament dla wielu dziedzin nauki – szczególnie chemii. Zgodnie z tym prawem masa substratów w zamkniętym układzie nie zmienia się w trakcie reakcji chemicznych, więc jest równa łącznej masie produktów.
Choć prawo to dotyczy głównie procesów chemicznych, ma także szerokie zastosowanie w: fizyce, biologii czy technologii. Jego odkrycie przez Antoine'a Lavoisiera zrewolucjonizowało nasze rozumienie procesów zachodzących w przyrodzie i stało się bardzo ważne dla rozwoju współczesnej nauki.













