Definicja prawa stałości związku chemicznego
Prawo stałości związku chemicznego (znane także jako prawo proporcji stałych) zostało sformułowane przez chemika – Josepha Prousta – w 1799 roku. Zgodnie z tym prawem każda substancja chemiczna składa się z konkretnych pierwiastków w związku chemicznym, w ściśle określonych proporcjach masowych, które pozostają niezmienne. Nie mają na to wpływu: pochodzenie substancji, jej sposób przygotowania czy warunki, w których jest przechowywana.
Na przykład woda (H₂O) zawsze będzie składać się z dwóch atomów wodoru i jednego atomu tlenu – niezależnie od tego, czy pochodzi z: rzeki, oceanu czy jest syntetyzowana w laboratorium. Stosunek mas pierwiastków wodoru i tlenu w cząsteczce wody jest zawsze stały (nie ulega zmianie) i wynosi: 11,11% masy wodoru oraz 88,89% masy tlenu.
Przeczytaj również:

Prawo zachowania masy – definicja, zadania
Znaczenie prawa stałości składu
Prawo stałości składu miało ogromne znaczenie nie tylko w rozwoju teorii chemii, ale także w jej praktyce. Umożliwiło lepsze zrozumienie obliczeń i reakcji chemicznych, pozwoliło na dokładniejsze określenie masy cząsteczkowej różnych związków oraz ułatwiło opracowanie metod syntez chemicznych. Dzięki temu prawo stałości przyczyniło się do rozwoju takich dziedzin, jak: analityka chemiczna, inżynieria chemiczna czy biochemia.
Przykłady ilustrujące prawo stałości składu związku chemicznego
Aby lepiej zobrazować i zrozumieć to prawo, warto przyjrzeć się kilku przykładom:
Dwutlenek węgla (CO₂) – każda cząsteczka dwutlenku węgla zawiera zawsze 1 atom węgla i 2 atomy tlenu (stosunek atomowy 1:2). Niezależnie od tego, czy jest pozyskiwana w laboratorium, czy powstaje w wyniku spalania węgla w tlenie.
Amoniak (NH₃) – każda cząsteczka amoniaku zawiera zawsze 1 atom azotu i 3 atomy wodoru w stałych proporcjach masowych, co oznacza, że stosunek atomowy to 1:3, a masowy 14:3,
Tlenek magnezu (MgO) – stosunek atomowy wynosi zawsze 1 do 1 (1:1). Natomiast stosunek masowy magnezu do tlenu zawsze będzie równy 3:2.
Zastosowania prawa stałości związku chemicznego
Prawo stałości związku chemicznego ma szerokie zastosowanie w różnych dziedzinach nauki i przemysłu. Należą do nich:
Chemia analityczna – w chemii analitycznej prawo stałości jest podstawą wielu technik analitycznych, takich jak: analiza wagowa, spektroskopia mas czy chromatografia. Dzięki stałym proporcjom masowym składników związku chemicznego możliwe jest dokładne określenie jego składu, a także wykrycie obecności danych substancji w próbkach.
Przemysł farmaceutyczny – leki muszą zawierać określoną ilość składników aktywnych w ściśle określonych proporcjach. Dzięki prawu stałości możliwe jest zapewnienie jakości i skuteczności leków produkowanych na szeroką skalę.
Przemysł spożywczy – również w przemyśle spożywczym prawo to ma swoje zastosowanie – szczególnie przy produkcji różnych substancji chemicznych, takich jak: dodatki do żywności, barwniki czy aromaty. Zapewnienie stałych proporcji składników gwarantuje, że produkt końcowy zawsze będzie miał identyczne właściwości.
Przeczytaj również:

Wzór na ciśnienie hydrostatyczne – jak obliczyć?
Prawo stałości a teoria atomistyczna
Prawo stałości związku chemicznego jest również ściśle związane z teorią atomistyczną, która mówi, że wszystkie substancje składają się z atomów, które łączą się w określonych proporcjach. Odkrycie Prousta pozwoliło na dalszy rozwój tej teorii, ponieważ potwierdziło, że atomy łączą się w ścisłe określonych proporcjach, co miało wpływ na późniejsze badania nad strukturą cząsteczek i atomów.
Zadania z wykorzystaniem stałości składu
Zadanie 1. Oblicz stosunek masowy pierwiastków w dwutlenku węgla (CO2).
Rozwiązanie:
masa węgla (z układu okresowego) = 12 u,
masa tlenu (z układu okresowego) = 2 × 16 u = 32 u.
Zapisujemy stosunek masowy pomiędzy tymi pierwiastkami (zależność pomiędzy nimi):
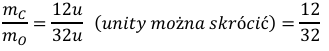
Ułamek maksymalnie skracamy:
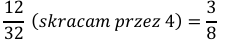
Odpowiedź: Stosunek masowy pierwiastków (węgla do tlenu) w dwutlenku węgla wynosi 3:8.
Zadanie 2. Oblicz stosunek atomowy magnezu i tlenu w wodorotlenku magnezu – Mg(OH)2.
Rozwiązanie: W wodorotlenku magnezu mamy do czynienia z trzema pierwiastkami. Jest 1 atom magnezu, 2 atomy tlenu oraz 2 atomy wodoru. Oznacza to, że stosunek atomowy magnezu do tlenu w tym związku to 1:2.
Odpowiedź: Stosunek atomowy magnezu do tlenu w wodorotlenku magnezu wynosi 1:2.
Podsumowanie – wiedza w pigułce
Prawo stałości składu chemicznego jest jednym z podstawowych praw w chemii. Oto najważniejsze informacje na jego temat zebrane w kilku podpunktach:
Definicja – w danym związku chemicznym stosunek mas atomów poszczególnych pierwiastków jest stały i charakterystyczny dla tego związku.
Historia – prawo to zostało sformułowane przez amerykańskiego chemika Josepha Prousta w XVIII wieku.
Przykład – w tlenku węgla (CO) stosunek masowy węgla do tlenu wynosi zawsze 12:16, co odpowiada proporcji 3:4.
Zastosowanie – wykorzystywanie prawa w różnych dziedzinach nauki i technologii, w tym: w przemysłowej produkcji substancji chemicznych, analizie chemicznej oraz w nauce chemii w szkole.
Wnioski – duże znaczenie tego prawa dla chemii, ponieważ pozwala na przewidywanie reakcji chemicznych. Dzięki temu chemicy mogą opracowywać nowe substancje i prowadzić syntezę chemiczną.













